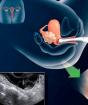
Постоянный сосудистый доступ для гемодиализа. Сосудистые доступы для гемодиализа
Подготовка и создание сосудистого доступа должно тать существенной частью преддиализной помощи и обучения пациентов с ХБП. Подготовка включает в себя сохранение вен для будущего сосудистого доступа и выбор адекватного времени, достаточного для планирования, создания и созревания сосудистого доступа.
Планирование сосудистого доступа
Артерио-венозная фистула, как правило, требует не менее 6 недель для созревания перед тем, как ее можно будет использовать для гемодиализа. Дополнительное время может потребоваться для консервативных или оперативных вмешательств в случаях замедленного созревания фистулы. По этой причине целесообразно создавать артерио-венозную фистулу, по меньшей мере, за 2-3 месяца до самого раннего из вероятных сроков начала диализа. Сосудистый протез не требует времени для созревания и может использоваться через 2-3 недели после имплантации. Но протез не может считаться оптимальным в качестве первого сосудистого доступа. Тем более следует избегать начала гемодиализа на центральных катетерах из-за риска инфицирования и потребности в продолжительной госпитализации.
Поскольку скорость прогрессирования ХБП часто нарастает непосредственно перед наступлением Vстадии ХБП, идеальным сроком принятия решения о подготовке сосудистого доступа является наступлениеIVстадии ХБП (снижение клубочковой фильтрации < 30 мл/мин) или даже ранее при документированном быстром прогрессировании ХБП или при других особых клинических условиях, затрудняющих создание сосудистого доступа (сахарный диабет, тяжелое заболевание периферических сосудов).
Предоперационная подготовка
Успешное создание и долгосрочное функционирование доступа во многом определяются предоперационным обследованием и подготовкой. Объективное обследование избранной конечности включает в себя оценку пульса на дистальном участке артерии и определение наличия, диаметра и хода вен на предплечье и плече. Объективное исследование затруднено у тучных пациентов. Предоперационное ультразвуковое исследование повышает шансы на успех создания и долговременного функционирования артерио-венозной фистулы: в рандомизированном исследовании применение УЗИ снижало риск несостоятельности фистулы с 25% до 6%. Хотя данные нескольких исследований противоречивы, диаметр лучевой артерии менее 1,6 мм, как правило, связан был с несопоставимо худшим прогнозом функционирования фистулы, скорость кровотока по артерии имела менее определенное значение. Диаметр вены менее 1,6 мм также ассоциировался с худшим прогнозом. Среди пациентов с хорошо функционирующими в последующем фистулами отмечалось увеличение диаметра вены после наложения венозного жгута на 48%, тогда как неудовлетворительному функционированию фистулы предшествовало увеличение диаметра вены при наложении жгута только на 12%. Политика сохранения вен для последующего создания сосудистого доступа на протяжении всего течения ХБП и физические упражнения для мышц предплечья способны увеличить диаметр и улучшить состояние вен и артерий для создания фистулы.
Рутинная венография с йодсодержащим контрастом перед созданием сосудистого доступа может вызвать необратимое снижение остаточной функции почек. Разумной альтернативой может стать гадолиний или контрастирование с СО 2 . ЯМР-ангиография (TOFили контрастирование с гадолинием) редко используется для планирования сосудистого доступа, но дает отлично совпадающие с обычной венографией результаты. Особенно точную информацию ЯМР-ангиография может дать о центральных венах.
Сосудистый доступ - это путь жизни пациентов, находящихся на гемодиализе. Сосудистый доступ делает возможным гемодиализное лечение, спасающее жизни. Гемодиализ - это лечение почечной недостаточности, при котором аппарат направляет кровь пациента через фильтр, называемый диализатором, вне тела. Доступ - операция на венах, сделанная, чтобы удалить и восстановить кровь во время гемодиализа.
Кровь течет через иглы, несколько унций одновременно. Затем кровь движется через трубку, которая доставляет ее к диализатору. Внутри диализатора кровь течет через тонкие волокна, которые отфильтровывают отходы и лишнюю жидкость. Машина возвращает кровь, отфильтрованную к телу, через другую трубу. Сосудистый доступ позволяет большому количеству непрерывного кровотока во время гемодиализной процедуры отфильтровывать как можно больше крови для каждой процедуры. Около 500 мл крови проходит через машину каждую минуту. Сосудистый доступ должен быть сделан за несколько недель или месяцев до первой процедуры гемодиализа.
Два типа сосудистого доступа, предназначенные для длительного использования, включают артериовенозный (AV) свищ и AV трансплантат. Третий тип сосудистого доступа - катетерная вена для кратковременного использования.
Что такое артериовенозный свищ?
AV фистула - это соединение, сделанное сосудистым хирургом, от артерии к вене. Артерии несут кровь от сердца к телу, в то время как вены переносят кровь от тела обратно к сердцу. Сосудистые хирурги специализируются на сосудистой хирургии. Хирург обычно помещает AV фистулу в руку или предплечье. AV фистула вызывает дополнительное давление и дополнительную кровь, чтобы течь в вену, таким образом, это становится большим и сильным. Большие вены обеспечивают легкий и надежный доступ к кровеносным сосудам. Без такого доступа регулярные сеансы гемодиализа будут невозможны. Нерегулируемые вены не выдерживают многократного введения иглы. Вены будут повреждены как сломанная солома из-за сильной силы всасывания.
- обеспечить хороший кровоток для диализа
- длиться дольше, чем другие виды доступа
- меньше вероятность заражения или образования тромбов, чем другие виды доступа
Перед операцией AV фистулы, хирург может провести анализ мазка крови. При картировании сосудов используется допплеровское ультразвуковое исследование для оценки кровеносных сосудов, которые хирурги могут использовать для создания АВ фистул. Ультразвук использует устройство, называемое преобразователем, которое отражает звуковые волны в органе для создания изображения структуры органа. Обученный техник специально выполняет процедуры в офисе поставщика медицинских услуг, в амбулаторном центре или в больнице. Радиолог, который специализируется на интерпретации изображений медицинских изображений. Пациент не анестезирован. Ультразвуковая допплерография показывает, сколько и как быстро кровь течет по артериям и венам, так что хирурги могут выбрать лучшие кровеносные сосуды для использования.
Хирург выполняет операцию на фистулу в амбулаторном центре или больнице. Процедуры сосудистого доступа могут потребовать ночлега в больнице; Тем не менее, многие пациенты уходят домой потом. Медицинские работники используют местную анестезию, чтобы обезболить область, где хирург создает фистулу.
АВ-свищам часто требуется от 2 до 3 месяцев для формирования или их можно использовать, прежде чем пациент сможет использовать их для гемодиализа. Если после операции провал AV фистулы, хирург должен повторить процедуру.
Что такое артериовенозный трансплантат?
АВ трансплантат представляет собой петлевую пластиковую трубку, которая соединяет артерии с венами. Сосудистый хирург выполняет операцию по трансплантации АВ, такую как операция по поводу фистулы, в амбулаторном центре или больнице. Как и при хирургии свищей AV, пациентам может потребоваться оставаться в больнице, хотя многие пациенты могут вернуться домой после процедуры. Медицинский работник использует местную анестезию, чтобы обезболить область, где хирург создает АВ трансплантат.
Пациент обычно может использовать трансплантат АВ через 2–3 недели после операции. АВ трансплантаты чаще, чем АВ фистулы, имеют проблемы с инфекцией и свертываемостью. Сгустки крови могут блокировать кровоток через поврежденную сперму. Однако хорошая пересадка может длиться несколько лет.
Что такое венозный катетер?
Венозный катетер - это трубка, которая вставляется в вену на шее, груди или ноге около паха, обычно только для краткосрочного гемодиализа. Трубка разделена на две трубки из корпуса. Две трубки имеют верх, предназначенный для соединения с каналом, по которому кровь поступает в диализатор, и каналом, по которому кровь поступает из диализатора обратно в организм. Человек должен закрывать зажим всякий раз, когда подключается и удаляется катетер из трубки.
Если заболевание почек развилось быстро, пациенты могут не успеть поместить АВ фистулу или АВ трансплантат до начала лечения гемодиализом.
Нефролог, врач, специализирующийся на проблемах с почками, или рентгенолог, используют медицинское оборудование для визуализации для проведения операции по установке венозного катетера в больнице или амбулаторном центре. Пациент получает местную анестезию и седативный эффект, чтобы оставаться спокойным и расслабленным во время процедуры.
Венозные катетеры не идеальны для длительного использования. С венозным катетером пациенты могут испытывать сгустки крови, инфекции или травмы вен, вызывая сужение кровеносных сосудов. Тем не менее, если пациенту необходимо начать гемодиализ напрямую, венозный катетер будет работать в течение нескольких недель или месяцев, пока хирург не сможет выполнить операцию по длительному доступу, и AV-фистула или AV-трансплантат успеют использоваться.
Если операция свища или трансплантата не удалась, пациенту потребуется доступ к долговременному венозному катетеру. Когда пациенту необходим венозный катетер в течение более 3 недель, хирург будет делать «туннель» катетера под кожей, а не вставлять его непосредственно в вену. Туннель катетера более удобен и имеет меньше проблем. Но туннельный катетер также может быть заражен.
Какие проблемы могут быть вызваны сосудистым доступом?
Все три типа сосудистого доступа (AV фистула, AV трансплантат и катетерная вена) могут вызвать проблемы, которые требуют дальнейшего лечения или хирургического вмешательства. Наиболее распространенные проблемы включают инфекцию доступа и низкий кровоток из-за доступа к тромбам.
Инфекция и слабый кровоток встречаются реже при АВ-свищах, которые хорошо сформированы, чем в АВ-трансплантате и венозном катетере. Тем не менее, наличие AV фистулы не гарантирует доступ будет беспроблемным.
АВ трансплантат чаще испытывает слабый кровоток, признаки свертывания или сужения доступа. Поврежденный АВ может потребовать ангиопластики, процедуры для расширения узкого участка. Другой вариант включает хирургическое вмешательство на трансплантате AV, который должен заменить узкую часть.
Венозный катетер чаще всего вызывает инфекции и проблемы со свертыванием. Если эта проблема развивается, использование лекарств может помочь. Антибиотики - это лекарства, которые борются с бактериями, которые могут вызвать инфекцию. Растворители крови, такие как варфарин, помогают избежать свертывания крови. Если это лечение не помогает, катетер должен заменить нефролог или специалист по радиологическому вмешательству.
Сосудистый доступ для гемодиализа
«ПОСТОЯННЫЙ СОСУДИСТЫЙ ДОСТУП ДЛЯ ГЕМОДИАЛИЗА: ХИРУРГИЧЕСКАЯ ТАКТИКА...»
-- [ Страница 1 ] --
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ
«НАЦИОНАЛЬНЫЙ МЕДИКО-ХИРУРГИЧЕСКИЙ ЦЕНТР
ИМЕНИ Н.И. ПИРОГОВА» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
На правах рукописи
МАНАФОВ ЭМИЛЬ НАЗИРОВИЧ
ПОСТОЯННЫЙ СОСУДИСТЫЙ ДОСТУП ДЛЯ ГЕМОДИАЛИЗА:
ХИРУРГИЧЕСКАЯ ТАКТИКА
14.01.26 – сердечно-сосудистая хирургия Диссертация на соискание ученой степени кандидата медицинских наукНаучный руководитель :
д.м.н., профессор Батрашов Владимир Алексеевич Москва - 2015
СПИСОК СОКРАЩЕНИЙ
ГЛАВА 2. КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА БОЛЬНЫХ,
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1 Клиническая характеристика больных
2.2 Разделение вмешательств на группы в зависимости от типа операции
2.3 Распределение операций в зависимости от топографо-анатомических особенностей
2.4 Методы исследования
2.5 Особенности оперативного вмешательства
2.6 Статистическая обработка данных
ГЛАВА 3. НЕПОСРЕДСТВЕННЫЕ И ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ
ОПЕРАТИВНОГО ЛЕЧЕНИЯ
3.1 Результаты раннего послеоперационного периода
3.2 Отдаленные результаты оперативного лечения
3.3 Причины осложнений сформированных постоянных сосудистых доступов
3.4 Анализ вторичной выживаемости постоянных сосудистых доступов
ГЛАВА 4. ПУТИ УЛУЧШЕНИЯ РЕЗУЛЬТАТОВ ФОРМИРОВАНИЯ
СОСУДИСТОГО ДОСТУПА У ПАЦИЕНТОВ НА ГЕМОДИАЛИЗЕ
4.1 Оценка роли предоперационного дуплексного сканирования при формировании ПСД
4.2 Формирование нативных артериовенозных фистул у пациентов старшей возрастной группы
4.3 Роль интраоперационной флоуметрии в хирургии постоянного сосудистого доступа
4.4 Динамическое наблюдение за сформированным постоянным сосудистым доступом
СПИСОК СОКРАЩЕНИЙ
АВФ – артериовенозная фистула АВШ – артериовенозный шунт АД – артериальное давление ГД – гемодиализ ЗПТ – заместительная почечная терапия ИМН – ишемическая мономелическая нейропатия МРА – магнитно-резонансная ангиография ПД – перитонеальный диализ ПСД – постоянный сосудистый доступ СД – сахарный диабет ССП – синтетический сосудистый протез ТХБП – терминальная стадия хронической болезни почек УЗАС – ультразвуковое ангиосканирование УЗДС – ультразвуковое дуплексное сканирование УЗИ – ультразвуковое исследование ХБП – хроническая болезнь почек ЦВК – центральный венозный катетер ЭД – эндотелиальная дисфункция ЭТН – эндотрахеальный наркоз KDOQI – Kidney Disease Outcome Quality Initiative PTFE – polytetrafluoroethylene, политетрафторэтиленВВЕДЕНИЕ
Актуальность проблемы Хронические болезни почек (ХБП) занимают среди хронических неинфекционных болезней особое место, поскольку они широко распространены, связаны с резким ухудшением качества жизни пациента и высокой смертностью . Развитие терминальной стадии ХБП (ТХБП) является логическим исходом прогрессирующего течения ХБП и соответствует понятию «почечной смерти». ТХБП приводит к необходимости применения дорогостоящих методов заместительной почечной терапии (ЗПТ) - диализа (гемодиализа (ГД) и перитонеального диализа (ПД)) и трансплантации почки . В США более 600 тысяч пациентов страдают ТХБП, 30% из которых имеют функционирующий почечный трансплантат; остальным проводится заместительная почечная терапия методом диализа .В России темпы роста количества больных с ТХБП опережают среднемировые значения и составляют по различным данным до 12% в год . По данным регистра Российского Диализного Общества различные виды ЗПТ получают более 24 тыс. человек . Средний возраст больных, получающих ЗПТ в нашей стране, составляет 47 лет, то есть в значительной мере страдает молодая, трудоспособная часть населения . Учитывая это, очевидно огромное социальное значение лечения больных с ХБП. Несмотря на то, что в последние годы количество операций по трансплантации почек в России существенно возросла, очевидным остается тот факт, что потребность в трансплантации среди пациентов, нуждающихся в пересадке почки, существенно превышает ее текущие объёмы .
Следовательно, таким пациентам проводятся другие виды ЗПТ. Среди них наибольшее распространение получил программный (хронический) ГД, который в нашей стране получают 91,3% пациентов; остальным 8,7% пациентов проводится ПД .
Для обеспечения длительной ЗПТ методом программного ГД необходимо наличие у пациента функционирующего постоянного сосудистого доступа (ПСД). В настоящее время эта проблема остаётся наиболее обсуждаемой среди специалистов, поскольку ни один из известных видов ПСД не является идеальным . Осложнения сосудистого доступа являются основной причиной его утраты, что приводит к необходимости повторных оперативных вмешательств по его формированию. Кроме того, осложнения ПСД отрицательным образом влияют на качество жизни пациентов и её продолжительность . Основными видами таких осложнений являются тромбозы, инфекции, венозная гипертензия, стилсиндром, псевдоаневризмы и другие. Тем или иным образом каждый из видов осложнений повышает риск дисфункции ПСД вплоть до полной его утраты. Нарушение функции ПСД отрицательно влияет на эффективность диализного лечения, а полная утрата доступа является угрозой для жизни пациента и требует дальнейшего обеспечения программного ГД через временные сосудистые доступы.
В настоящее время среди видов ПСД наиболее предпочтительным является создание нативной артериовенозной фистулы (АВФ), которая демонстрирует наилучшие результаты проходимости в отдаленном периоде и низкий риск развития осложнений . Несмотря на это, далеко не всем пациентам возможно сформировать данный вид ПСД, ввиду отсутствия пригодных артерий и вен, а также наличия значимой сопутствующей кардиальной патологии. Альтернативными видами сосудистого доступа служат артериовенозный шунт (АВШ) с использованием синтетического сосудистого протеза и туннельный центральный венозный катетер (ЦВК) для ГД. Следует отметить, что наличие у пациента пригодных артерий и вен не является абсолютным гарантом успешного исхода операции. На сегодняшний момент в хирургии сосудистого доступа остается множество вопросов, посвященных созданию адекватного ПСД и поддержанию его функционирования. Несомненно, что прогнозирование результатов хирургических вмешательств у таких больных и правильная оценка факторов риска являются важными аспектами в хирургии сосудистого доступа. В профилактике осложнений ПСД существенную роль играет динамическое наблюдение и объективная оценка факторов риска . Следует отметить, что своевременное обнаружение причин дисфункции позволяет оперативно принять меры по их устранению. Такая тактика позволяет поддерживать сформированный ПСД в функциональном состоянии на максимально возможный срок.
Учитывая ежегодный рост числа пациентов с ТХБП и постоянное совершенствование медицинских технологий в сфере диализного лечения, требования к ПСД неуклонно возрастают. В связи с этим, проблема формирования и поддержания длительно функционирующего ПСД требует от хирургов и врачей смежных специальностей более глубокого понимания данного вопроса, который в настоящий момент остается малоизученным.
Выявление основных ошибок при формировании ПСД и оценка факторов риска развития осложнений поможет улучшить результаты формирования доступа у диализных пациентов и избежать повторных оперативных вмешательств.
Цель исследования Улучшить результаты формирования постоянного сосудистого доступа у пациентов на программном гемодиализе.
Задачи исследования
1. Оценить отдаленные результаты формирования ПСД у больных на программном гемодиализе в зависимости от вида сформированного доступа.
2. Выявить наиболее предпочтительный вид ПСД и условия для его формирования.
3. Изучить влияние реконструктивных вмешательств на сроки функционирования осложненного ПСД.
4. Оценить роль дополнительных методов интраоперационного контроля в хирургии ПСД.
5. Оценить влияние предоперационного УЗДС на результаты формирования ПСД.
Научная новизна работы Впервые на основании большого клинического материала изучены отдаленные результаты формирования АВФ и АВШ, а также факторы риска развития осложнений этих видов ПСД у пациентов на программном ГД.
Впервые оценен вклад каждого фактора в риск развития периоперационных осложнений и их влияние на отдаленные результаты операций по формированию ПСД.
На основании полученных данных разработан оптимальный алгоритм по формированию и поддержанию функциональности ПСД.
Практическая значимость работы
Практическая ценность работы заключается в том, что в данной работе проведен анализ непосредственных и отдаленных результатов хирургических вмешательств по формированию ПСД у пациентов на программном ГД.
Выполнена оценка длительности функционирования ПСД в зависимости от вида сформированного доступа.
Проведена оценка эффективности методов предоперационного и интраоперационного контроля гемодинамических характеристик ПСД и их влияние на результат оперативного лечения.
Проведена оценка роли ряда факторов в развитии осложнений и утраты ПСД.
С учетом современных аспектов понимания патогенетических механизмов развития осложнений ПСД даны рекомендации по динамическому наблюдению пациентов с функционирующим доступом для программного ГД.
На основании проведенного исследования предложен алгоритм хирургической тактики формирования ПСД и динамического наблюдения пациентов на программном ГД.
Результаты работы были внедрены в клиническую практику при лечении пациентов с ТХБП на базе ФГБУ «НМХЦ им. Н.И. Пирогова»
Минздрава России.
Положения, выносимые на защиту Нативная АВФ демонстрирует более длительные сроки 1.
функционирования в отдаленном послеоперационном периоде в сравнении в протезным АВШ.
Своевременное выполнение реконструктивных операций при 2.
дисфункции ПСД позволяет улучшить отдаленные результаты формирования АВФ и АВШ у пациентов на программном ГД.
Выполнение прецизионного ультразвукового ангиосканирования перед 3.
операцией улучшает результаты формирования ПСД.
Метод интраоперационной флоуметрии позволяет снизить частоту 4.
развития доступ-ассоциированного стил-синдрома и ранней утраты ПСД.
Создание нативной АВФ в качестве ПСД показано пациентам всех 5.
возрастных групп при условии наличия пригодных артерий и вен для её формирования.
Реализация результатов исследования.
Основные положения диссертации внедрены в практику ФГБУ «Национальный медико-хирургический центр им. Н.И. Пирогова» Минздрава России.
Апробация диссертации Материалы диссертационного исследования доложены и обсуждены на конференциях: XXVIII международной конференции Российского общества ангиологов и сосудистых хирургов «Новые направления и отдаленные результаты открытых и эндоваскулярных вмешательств в лечении сосудистых больных» (Новосибирск, 2013); XXIX международной конференции Российского общества ангиологов и сосудистых хирургов «Новые направления и отдаленные результаты открытых и эндоваскулярных вмешательств в лечении сосудистых больных» (Рязань, 2014); Президентская конференция ФГБУ «НМХЦ им. Н.И. Пирогова» Минздрава России (Москва, 2014).
Публикации По материалам диссертации опубликовано 5 научных работ, в том числе 2 статьи в журналах, рекомендованных ВАК.
Структура и объем работы Диссертация изложена в традиционной форме и состоит из введения, обзора литературы, 4-х глав собственных исследований, заключения, выводов, практических рекомендаций и списка литературы.
Работа представлена на 109 страницах машинописного текста, иллюстрирована 33 рисунками и 8 таблицами.
Библиографический указатель включает 16 работ на русском и 93 работы на иностранных языках.
ГЛАВА 1. ФОРМИРОВАНИЕ ПОСТОЯННОГО СОСУДИСТОГО
ДОСТУПА У БОЛЬНЫХ НА ПРОГРАММНОМ ГЕМОДИАЛИЗЕ:
СОВРЕМЕННОЕ СОСТОЯНИЕ ПРОБЛЕМЫ (ОБЗОР ЛИТЕРАТУРЫ)
1.1. Эпидемиология С середины 1990-х годов в мире повсеместно констатируется неуклонный рост числа больных с хроническими заболеваниями почек.
Хроническая болезнь почек (ХБП) – это наднозологическое понятие, характеризующееся повреждением почек и/или снижением их функции в течение 3-х и более месяцев . В настоящее время около 5% взрослого населения нашей планеты страдает ХБП . По различных данным количество больных с ХБП увеличивается ежегодно на 10–12% . В России до 10 млн. человек имеют диагноз ХБП .
Важно отметить, что в последние десятилетия величина этого показателя существенно выросла в старшей возрастной группе (15–30% среди лиц старше 60 лет). Главными причинами непрерывного повсеместного возрастания количества больных с ХБП являются изменения социальных условий и демографических характеристик населения земного шара. Это привело как к общему старению населения, так и к росту заболеваемости сахарным диабетом (главным образом, 2-го типа), артериальной гипертонией и атеросклерозом, для которых характерно вовлечение в патологический процесс сосудистой системы почек с развитием так называемых почечных васкулопатий . Важно отметить, что смертность от осложнений, возникающих на фоне ХБП, значительно выше, чем от самой болезни.
В настоящее время основным способом лечения хронической почечной недостаточности является заместительная почечная терапия (ЗПТ), которая осуществляется посредством диализа (ГД и ПД) или трансплантации донорской почки.
Среди видов заместительной почечной терапии доминирует ГД (71,6% от общего числа обеспеченных ЗПТ), второе место принадлежит трансплантации почки (21,4%), а на долю ПД приходится 7,1% .
Гемодиализ, являясь основным методом заместительного лечения хронической почечной недостаточности, обеспечивает не только спасение жизни больных, но и способствует увеличению её продолжительности и повышению качества. Причем современный диализ позволяет сохранить трудоспособность и обеспечить достаточно высокий уровень жизни больных.
Оставаясь в течение последних 30 лет методом выбора в лечении пациентов с терминальной стадией ХПН, ГД и в настоящее время поддерживает жизнь более миллиона человек по всему миру .
Следует отметить, что необходимым условием для долговременного обеспечения ЗПТ методом хронического ГД является наличие у пациента постоянного сосудистого доступа (ПСД) . Формирование, уход и поддержание функциональности доступа требует высокой квалификации как специалистов хирургического и терапевтического профилей, так и среднего медперсонала .
1.2. История развития ПСД История развития хирургии сосудистого доступа тесно связана с развитием ГД . Впервые термин «диализ» ввёл в своей работе шотландский химик Thomas Graham в 1854 году для описания процесса осмотической диффузии веществ через полупроницаемую мембрану . В 1913 году John Abel и его коллеги Rowentry и Turner из Балтимора создали устройство для удаления растворенных веществ из крови собак и назвали его «искусственной почкой» .
Позднее в 1924 году немецкий ученый Georg Haas впервые провел процедуру ГД для лечения пациента с уремией. При этом он использовал стеклянные трубки для забора крови из лучевой артерии и возврата её в локтевую вену, а длительность самой процедуры составила всего 15 минут. В связи с крайне малой площадью поверхности диализных мембран, которая на тот момент редко превышала 2 м2, процедура ГД оставалась неэффективной. В 1943 году молодой голландский учёный Willem Kolff совместно с Berk разработал «барабанный» диализатор, имеющий большую площадь мембранной поверхности, с помощью которого впервые добился успешного выведения человека из уремической комы 3 сентября 1945 года .
Несмотря на это, длительное лечение ГД по-прежнему оставалось невозможным по причине быстрого истощения резерва сосудистого доступа.
Канюляция артерии требовала выполнения открытого хирургического доступа к ней, после чего артерия на значительном протяжении оказывалась непригодной для повторной процедуры. В связи с этим, ГД активно применялся только у пациентов с острой почечной недостаточностью. Об использовании данного метода с целью проведения хронического ГД не могло быть и речи.
Ситуация резко изменилась в 1960-х годах, когда Quinton, Dillard и Scribner натолкнулись на идею соединения артерии и вены с помощью канюль и резиновой трубки, предложенную ранее Nils Alwall. Доработанная ими конструкция представляла собой две канюли из тонкостенных тефлоновых трубок, имплантированных в лучевую артерию и подкожную вену (v. сephalica) в нижней части предплечья. Наружные концы шунта соединялись изогнутой тефлоновой трубкой .
Таким образом, в 1960-м году, благодаря впервые сформированному постоянному сосудистому доступу, было положено начало лечению пациентов с почечной недостаточностью методом хронического ГД. Одна из наиболее важных и прогрессивных разработок, позволившая расширить интерес к хроническому ГД, была сделана Cimino совместно c Brescia и Appell . 19-го февраля 1965 года ими впервые была выполнена операция по формированию АВФ для последующего проведения ГД, используя артериализированную вену. Врач-хирург Appell сформировал анастомоз по типу «бок в бок» между лучевой артерией и подкожной веной (v.cephalica) в области запястья, предварительно выполнив артерио- и венотомию на протяжении 3-5 мм.
Впоследствии в научных изданиях периодически сообщалось о различных вариантах формирования анастомоза при создании АВФ. Sperling в 1967 году успешно выполнил анастомоз по типу «конец в конец» , однако, из-за частого развития стил-синдрома подобный вид фистул не подходил в качестве метода выбора при формировании первичного сосудистого доступа. Позднее, в 1968 году немецкий хирург Lars Rhl сообщил об успешном опыте формирования тридцати артериовенозных анастомозов по типу «конец вены в бок артерии». В настоящее время именно этот вариант формирования АВФ остается методом выбора для создания ПСД .
Появление в сосудистой хирургии синтетических протезов дало новый виток развитию хирургии сосудистого доступа. В 1976 году Baker представил первые результаты использования протезов из политетрафторэтилена (PTFE) при формировании доступа у 72 больных, которые оказались достаточно оптимистичными. Использование дакрона в качестве материала для протеза, напротив, оказалось малоуспешным. PTFE и по сей день остаётся наиболее предпочтительным материалом при создании протезов для формирования ПСД .
Позднее, после публикации Gordon и Glanz «Лечение стенозов диализных фистул и шунтов методом транслюминарной ангиопластики» в 1982 году, началась эра чрескожных хирургических вмешательств на сосудистом доступе. Накопленный опыт эндоваскулярных хирургов продемонстрировал, что плохая техника пункции ПСД не только приводит к скорой утрате доступа, но и способствует развитию стенозов и ложных аневризм.
Таким образом, хирургия сосудистого доступа стала междисциплинарной областью современной медицины. Основанная пионерами из области нефрологии, она постепенно вовлекала в себя тогда ещё молодую дисциплину, какой являлась сосудистая хирургия.
С начала 1970-х годов с ростом количества осложнений при формировании ПСД нефрологи всё больше старались привлекать к сотрудничеству сосудистых хирургов. Многие годы формирование сосудистого доступа остаётся исключительно хирургической задачей. Это требует не только организации работы с целью сохранения поверхностных вен пациента на предиализном этапе, наблюдения и ухода за уже сформированным ПСД, но и свежих теоретических знаний в сфере хирургии сосудистого доступа, а также обеспечения тесного сотрудничества специалистов нефрологического, диализного, ангиохирургического и рентген-хирургического отделений . На сегодняшний день необходим новый комплексный подход к проблеме постоянного сосудистого доступа с учетом допущенных в прошлом ошибок и накопленного опыта.
Одним из первых шагов к этому стало опубликованное в 2008 году Обществом Сосудистых Хирургов (Society for Vascular Surgery, SVS) практическое руководство по формированию и поддержанию постоянного сосудистого доступа . Эксперты постарались охватить многие вопросы, которые возникают в процессе лечения: сроки поступления больного в нефрологическое отделение, инструментальное обследование, тактика при формировании и поддержании ПСД, профилактика развития осложнений и их лечение.
1.3. Современный сосудистый доступ для ГД В настоящее время существует три основных вида сосудистого доступа для проведения ГД, однако, необходимо отметить, что каждый из них обладает как преимуществами, так и недостатками.
1. Нативная АВФ.
Формируется посредством создания прямого анастомоза между артерией и близлежащей поверхностной веной. Включение вены в артериальный кровоток приводит к расширению её просвета и утолщению её стенок. Данный процесс называется артериализацией или «созреванием»
фистулы, и он необходим для возможности последующих многократных пункций. Как правило, процесс «созревания» занимает от 6 до 16 недель.
2. Протезный АВШ.
Используется у пациентов, которым по тем или иным причинам невозможно сформировать нативную АВФ. Протезный шунт может быть, как синтетическим (как правило, из PTFE), так и биологическим (аутошунт, аллошунт, ксеношунт).
3. Туннельный ЦВК.
Несмотря на многочисленные рекомендации, призывающие максимально отказаться от его использования, временный ЦВК остаётся наиболее частым сосудистым доступом у больных, начинающих лечение хроническим ГД, а также при необходимости его проведения в экстренном порядке. В случае продолжительного (более 3-х недель) лечения ГД, рекомендована замена временного ЦВК на туннельный.
На хирургическую тактику при планировании создания оптимального сосудистого доступа влияют такие факторы, как состояние артериального и венозного сосудистого русла, ожидаемая продолжительность жизни пациента и тяжесть сопутствующей патологии .
1.3.1. Нативная АВФ Зрелая нативная АВФ является наиболее предпочтительным видом ПСД благодаря наименьшему риску развития инфекционных и тромботических осложнений . По данным литературы показатель первичной выживаемости АВФ составляет 50% в течение 5-ти лет с момента формирования. В то же самое время аналогичный показатель при использовании протеза – 10%.
Существует три варианта нативной АВФ в зависимости от её топографоанатомических характеристик:
1) Простая прямая АВФ, формируемая путем соединения артерии и вены в их исходных анатомических позициях. Чаще других используют анастомозы по типу «бок в бок» или «конец вены в бок артерии»
2) АВФ с транспозицией вены, при которой дистальный участок вены перемещают в другую анатомическую область для создания анастомоза с артерией, либо для более поверхностного её расположения с целью обеспечения удобства последующих пункций. Для этого, как правило, формируется подкожный туннель, где и располагают транспонированную вену.
3) АВФ с транслокацией вены, при которой вена полностью перемещается в другую анатомическую область, где выполняет роль шунта между артерией и веной. Транслоцированная вена также требует формирования подкожного туннеля для поверхностного расположения.
Важно отметить, что каждому типу анастомоза присущи свои преимущества и недостатки. Широкий анастомоз по типу «бок в бок» без лигирования дистального венозного русла часто приводит к явлениям венозной гипертензии. В то же время популярный в 1970-е годы анастомоз «конец в конец» является технически более простым, однако, впоследствии часто приводит к ишемии дистальных участков конечности и артериальному тромбозу . Сегодня широко распространен анастомоз по типу «конец в бок». Очень важно при этом создать правильный угол между артерией и веной, а также не допустить перекручивания вены вокруг своей оси.
Подобные ошибки приводят в дальнейшем к нарушению созревания АВФ и стенозированию её просвета. Артериальный анастомоз должен формироваться наиболее проксимально и быть минимально широким с целью ограничения кровотока по АВФ, что в свою очередь является мерой профилактики развития стил-синдрома и сердечной недостаточности в послеоперационном периоде.
В литературе можно встретить различные данные относительно сроков функционирования нативных АВФ. Однако, в совокупности, по данным различных авторов результаты первичной выживаемости составляют 41-93% . Примечательно, что низкий процент выживаемости ПСД наблюдался в лечебных центрах, где операции по формированию нативных АВФ являлись относительно редкими, а, следовательно, можно думать об отрицательном влиянии на результат недостаточного опыта хирургов и специалистов нефрологических отделений.
Основной причиной ранней утраты сформированной нативной АВФ является нарушение её созревания . Частота подобных нарушений, по различным данным, достигает 60% . Исследования показали, что нарушение созревания, как правило, ассоциировалось с пожилым возрастом пациентов, женском полом, наличием избыточной массы тела, сопутствующим сахарным диабетом, сердечно-сосудистыми заболеваниями и низким системным АД .
1.3.2. Протезный АВШ Пациентам, которым по тем или иным причинам невозможно сформировать нативную АВФ, показано формирование ПСД с использованием синтетического сосудистого протеза . Идеальный материал для протеза должен обладать следующими свойствами:
биосовместимость, атромбогенность, устойчивость к инфекции, простота имплантирования, экономичность/доступность, устойчивость к многократным пункциям . В настоящее время в сосудистой хирургии применяются протезы из различных материалов (дакрон, полиуретан и др.) , однако, в качестве шунта при формировании ПСД лучше других себя зарекомендовали протезы из ePTFE (expanded polytetrafluoroethylene, растянутый политетрафторэтилен) - биологически инертного синтетического полимера на основе углерода и флюорина. ПСД с использованием протеза в настоящее время наиболее широко распространены в Соединенных Штатах Америки .
Основными преимуществами создания протезного АВШ являются относительная простота формирования и отсутствие как такового периода созревания фистулы, а, следовательно, возможность проведения ГД в кратчайшие сроки после оперативного вмешательства. При отсутствии адекватного венозного русла и неудачных попытках формирования нативных АВФ на предплечье, в дальнейшем предпочтение также отдаётся имплантации протеза . Частота тромбозов протезного АВШ крайне низка в раннем послеоперационном периоде, однако, в долгосрочной перспективе показатели выживаемости резко снижаются и составляют по данным различных авторов от 40% до 54% .
Другим недостатком служит тот факт, что протезный материал является субстратом для развития инфекции . Также наличие синтетического протеза увеличивает риск развития стенозов, обусловленных гиперплазией неоинтимы. Большинство стенозов локализуется в области сформированных анастомозов, что со временем приводит к снижению кровотока и, как следствие, к утрате доступа . При возникновении значимых стенозов для сохранения функции ПСД применяют баллонную ангиопластику и стентирование . В настоящее время исследования в области тканевой инженерии направлены на создание полноценного аутологичного протеза с имплантированными на его поверхность фибробластами и эндотелиальными клетками пациента .
Ожидается, что подобная технология позволит значительно снизить частоту развития тромботических и инфекционных осложнений при формировании ПСД с использованием протеза.
1.3.3. Центральный венозный катетер Туннельный ЦВК является тем видом сосудистого доступа, установка которого не требует выполнения открытого хирургического доступа.
Установка временного ЦВК, как правило, выполняется для экстренного проведения ГД. Далее необходимо рассмотреть вопрос о формировании пациенту АВФ или АВШ. В случае увеличения сроков лечения методом ГД и отсутствия возможности сформировать иной вид ПСД, рекомендована замена временного ЦВК на туннельный. В целом у ЦВК, как и любого другого вида ПСД, есть как свои достоинства, так и недостатки. ЦВК обеспечивает быстрый доступ к кровотоку, не оказывает влияния на системную гемодинамику (не вызывает развития стил-синдрома, сердечной недостаточности и легочной гипертензии). Кроме того, проведение ГД через ЦВК не требует многократных пункций вен. С другой стороны, использование ЦВК связано с высоким риском развития инфекции, тромбоза, центрального венозного стеноза . По статистике частота морбидности и смертности вследствие осложнений ЦВК значительно выше, чем при использовании АВФ в качестве ПСД .
1.4. Осложнения сосудистого доступа Формирование ПСД для проведения ГД несомненно является важным этапом в лечении пациентов с терминальной стадией ХБП, однако, не менее важным является поддержание его функциональности. Дисфункция ПСД является основной причиной госпитализации диализных пациентов .
1.4.1. Ранняя дисфункция ПСД и гиперплазия интимы.
Дисфункцию ПСД можно разделить на раннюю (от момента формирования до начала проведения диализного лечения через ПСД) и позднюю (в процессе диализного лечения). В случае нативной АВФ ранняя дисфункция чаще обусловлена нарушением процесса созревания фистулы, вследствие чего не достигается артериализация вены. Это делает невозможным дальнейшее её использование для проведения ГД. По данным литературы, в Европе и США частота ранней дисфункции ПСД составляет от 23% до 46% . Причины нарушения созревания включают: использование для формирования ПСД сосудов малого диаметра (артерия 2 мм, вена 2.5 мм), погрешности в хирургической технике, рассыпной тип венозной сети, низкое АД. Следовательно, для достижения наилучшего результата при формировании ПСД хирург должен иметь полную картину топографоанатомических особенностей строения артерий и вен на оперируемой конечности, знать требования, предъявляемые к функционирующему ПСД, а также хорошо владеть техникой создания сосудистых анастомозов.
Другой важной причиной дисфункции сосудистого доступа является наличие стенозов, снижающих скорость кровотока по фистуле или шунту, что отрицательно влияет на эффективность диализного лечения, а также значительно повышает риск тромбирования ПСД. Первичные стенозы чаще являются результатом погрешностей в хирургической технике при создании сосудистого анастомоза. В остальных случаях сужение просвета фистулы и шунта является следствием гиперплазии интимы сосудистой стенки. Участки гиперплазии чаще локализованы в области венозного анастомоза и образованы гладкомышечными клетками, мигрировавшими из слоя медии в интимальный слой.
Триггером для данного процесса является механическое повреждение эндотелиальных и гладкомышечных клеток вследствие хирургической манипуляции и формирования турбулентного кровотока на данном участке. Это, в свою очередь, провоцирует локальную эксперессию таких цитокинов и медиаторов, как эндотелин, PDGF (Platelet-derived growth factor, тромбоцитаный фактор роста), TGF- (Transforming growth factor beta, трансформирующий ростовой фактор бета), VEGF (Vascular endothelial growth factor, фактор роста эндотелия сосудов) .
Следует отметить, что на процесс созревания, по мнению ряда исследователей, отрицательно влияет состояние сосудистой стенки у пациентов с ХБП Результаты исследований демонстрируют .
отрицательное влияние таких факторов, как хроническое воспаление, хроническая уремия и эндотелиальная дисфункция на результаты созревания АВФ.
В настоящее время по всему миру активно изучаются механизмы, приводящие к гиперплазии интимы. Предложен целый ряд методик, направленных на предупреждение её развития: баллонная ангиопластика и установка стентов с лекарственным покрытием, криопластика, радиотерапия, клеточная и генная терапия, а также системная фармакотерапия. Несмотря на это, на данный момент, ни один из подходов не продемонстрировал достоверного положительного результата в долгосрочном периоде .
1.4.2. Тромбозы Тромбозы являются наиболее частой причиной утраты сосудистого доступа. По данным различных авторов, данный вид осложнений встречается в 70-95% случаев . Причинами развития тромбоза ПСД, как правило, являются снижение скорости кровотока по фистуле или шунту, повреждение стенки сосуда и нарушения в системе гемостаза. В свою очередь, снижение скорости кровотока может быть обусловлено стенозирующим поражением сосудов, нарушением реологических свойств крови и низким системным АД. По данным ангиографических исследований, стенозирующее поражение обнаруживается в более чем 85% тромбированных доступов . Наиболее частой локализацией стеноза является область венозного анастомоза. Основной причиной развития венозных стенозов является гиперплазия интимы . Существует по крайней мере два механизма развития тромбоза вследствие стенозирования просвета. Во-первых, гемодинамически значимый стеноз приводит к снижению кровотока по АВФ или АВШ, а также повышению давления проксимальнее места стеноза. Это приводит к усилению взаимодействия между тромбоцитами, факторами свертывания и стенкой сосуда. Во-вторых, стеноз сам по себе приводит к увеличению линейной скорости кровотока и усилению напряжения стенки непосредственно в области стеноза, что также приводит к повышенной адгезии и агрегации тромбоцитов . Согласно рекомендациям KDOQI (Kidney Disease Outcome Quality Initiative, США) наличие 50% стеноза просвета АВФ или АВШ является показанием к профилактическому лечению открытым хирургическим либо эндоваскулярным методом . Однако, стеноз не является единственной причиной тромбоза. По данным литературы приблизительно в 15% тромбозов стенозирующие поражения рентгенологически отсутствуют . Предполагается, что большинство эпизодов тромбоза происходит ночью, зачастую после очередной процедуры ГД. Это обусловлено развивающейся в постдиализном периоде гемоконцентрацией и сниженным сердечным выбросом, что может приводить к тромбозу шунта . В случае раннего (30 дней после формирования ПСД) тромбоза наиболее частыми причинами служат недостаточность артериального притока, нарушения венозного оттока и стеноз в области сформированного анастомоза . В случае тромбоза, с целью сохранения сосудистого доступа показано выполнение тромбэктомии открытым либо эндоваскулярным методом . Наряду с этим необходимо провести дообследование с целью выявления возможных причин тромбоза.
После тромбэктомии нативная АВФ имеет ограниченный срок службы, в то время как протезный доступ после тромбэктомии можно полноценно использовать в дальнейшем. Зачастую, протезы могут тромбироваться несколько раз, прежде чем происходит его полное закрытие. Хотя необходимо отметить, что при сравнении с нативной АВФ, протезные АВШ больше подвержены тромбозу даже при относительно высокой скорости кровотока .
1.4.3. Инфекции Инфицирование ПСД является второй по распространенности причиной утраты как протезных АВШ, так и нативных АВФ, а также является частой причиной госпитализации диализных пациентов . По статистике инфекционные осложнения занимают второе место в структуре причин смерти этих больных . Одним из факторов повышенного риска развития инфекции является сниженная иммунная функция у пациентов на хроническом ГД . Чрескожные катетеры также являются частой причиной их развития . Установка синтетического протеза является фактором риска интраоперационного инфицирования, а также развития инфекции в месте пункции, по сравнению с аналогичными показателями при использовании нативной АВФ, которые, в основном, ограничены инфицированием подкожных гематом и псевдоаневризм .
Низкий риск инфекции является основным из преимуществ нативных АВФ.
Частота развития инфекционных осложнений среди пациентов с протезным АВШ по разным данным составляет от 3,5% до 19% .
Стандартного проведения антибактериальной терапии, как правило, бывает недостаточно. Таким образом, в случае инфицирования протезного АВШ пациенту показано оперативное вмешательство с целью тотальной, субтотальной или сегментарной резекции инфицированного шунта.
1.4.4. Синдром артериального обкрадывания (доступассоциированный стил-синдром) Феномен артериального обкрадывания, или стил-синдром, описанный впервые Storey в 1969 году у пациентов с АВФ, обусловлен снижением артериального кровотока, приводящим к ишемии конечности . Стилсиндром может стать причиной трофических нарушений вплоть до потери конечности, поэтому требует клинической настороженности сосудистых хирургов и нефрологов. Целью лечения синдрома обкрадывания является восстановление антеградного артериального кровотока в конечности и сохранение функционирующего ПСД для проведения ГД. Чаще стилсиндром развивается при формировании протезных АВШ, что обусловлено большим диаметром сосудистого просвета. Диагностировать стил-синдром в раннем послеоперационном периоде удаётся в 75% случаев. Следует учесть, что под определение стил-синдрома попадает любое достоверное снижение дистального артериального кровотока, что вовсе не подразумевает наличие клинических проявлений ишемии. По данным литературы явления парестезии и похолодание пальцев рук отмечается в ~10% первично сформированных ПСД . Чаще эти симптомы не требуют активного лечения и исчезают самостоятельно через несколько недель.
Клинически значимые симптомы возникают в 1% случаев с нативными АВФ и 9% случаев с протезными АВШ .
В настоящее время не существует методов обследования, способных на предоперационном этапе достоверно предугадать развитие стил-синдрома.
Тем не менее, существует часть пациентов, которых можно отнести к группе высокого риска по следующим параметрам: пожилой возраст, неоднократные операции на конечности, окклюзирующие заболевания периферических артерий, сахарный диабет (СД). Использование синтетического протеза при операции на плечевой артерии в значительной степени повышает риск развития стил-синдрома .
Физиологически феномен обкрадывания ведет к компенсаторному увеличению артериального кровотока посредством повышения частоты сердечных сокращений и сердечного выброса, а также возможной артериальной вазодилатации. Чаще стил-синдром развивается при увеличенном периферическом сопротивлении или проксимальном стенозе, что повышает риск его развития у пациентов с сахарным диабетом и гипертонической болезнью. Также причиной развития синдрома обкрадывания часто служит создание широкого анастомоза при формировании АВФ. Для коррекции проксимального артериального стеноза чаще используют эндоваскулярные вмешательства: баллонную ангиопластику или стентирование. При обкрадывании, обусловленным поражением дистального русла чаще применяют хирургические методы коррекции, направленные на проксимализацию артериального анастомоза фистулы и уменьшение диаметра её просвета . При развитии выраженного стил-синдрома и невозможности улучшения дистального артериального русла, единственно возможным вариантом лечения является лигирование фистулы .
1.4.5. Венозная гипертензия Явления венозной гипертензии после формирования ПСД обусловлены центральным венозным стенозом вплоть до окклюзии или ретроградным венозным кровотоком при клапанной недостаточности периферических вен.
Частота развития центральных венозных стенозов у пациентов на ГД по разным данным составляет 5-20% . Известно, что в 50% случаев после постановки подключичного катетера развивается значимый (50%) стеноз в месте пункции вены . При катетеризации внутренней яремной вены аналогичный показатель составляет только 10%. По этой причине внутренняя яремная вена является приоритетной для постановки внутривенных катетеров .
Основными причинами развития центрального венозного стеноза является многократное пунктирование центральной вены и длительное стояние венозного катетера. Стенозирующее поражение центральных вен не всегда может проявляться клинически, поэтому, прежде чем формировать ПСД, необходимо проводить инструментальное обследование для изучения состояния венозного русла. Наличие значимых стенозов ведет к несостоятельности ПСД в послеоперационном периоде. Таким образом, при обнаружении стенотического поражения магистральной вены, от планирования каких-либо операций по формированию ПСД на данной конечности необходимо воздержаться. Профилактика и лечение центральных венозных стенозов является приоритетной задачей в терапии диализных больных .
1.4.6. Псевдоаневризмы.
Наличие псевдоаневризм повышает риск развития таких осложнений, как тромбоз ПСД, инфицирование, кровотечение, болевой синдром и косметический дефект Формирование псевдоаневризм при .
использовании PTFE-шунта происходит по разным данным от 2% до 10% случаев . Образование плотной соединительно-тканной капсулы вокруг шунта снижает риск образования аневризм. С другой стороны, использование игл большого диаметра, способствующих формированию разрывов и фрагментации стенки протеза, многократные пункции одной и той же области, а также недостаточная плотность сформированной соединительно-тканной капсулы вокруг протеза ведет к образованию перипротезных гематом и псевдоаневризм. Другой причиной, способствующей образованию аневризм является повышение давления внутри протеза в результате стенозирования просвета в области венозного анастомоза. В случае с нативной АВФ, как правило, имеют место истинные аневризмы, представляющие собой расширенный участок артериализованной вены . Само по себе наличие аневризматического расширения не является показанием к хирургическому лечению. Коррекция проводится с целью предотвращения её разрыва. Показанием к этому служат крупные размеры аневризмы, а также трофические изменения кожных покровов над ней .
1.4.7. Сердечная недостаточность Наличие функционирующего ПСД подразумевает тот факт, что значительная часть крови шунтируется по нему из артериального сосудистого бассейна в венозный, тем самым увеличивая преднагрузку на сердце. Такое изменение гемодинамики, в свою очередь, ведет к компенсаторному увеличению сердечного выброса. С течением времени подобная повышенная нагрузка на сердце может привести к гипертрофии сердечной мышцы и, как следствие, к сердечной недостаточности.
По данным литературы 31-36% пациентов с ТХПН на момент начала лечения программным ГД уже имеют признаки сердечной недостаточности . За время лечения данная патология развивается ещё у 25% больных. Проведенные исследования не подтверждают прямую зависимость между скоростью кровотока по фистуле и частотой развития сердечной недостаточности Гораздо большее значение имеет состояние .
кардиальной мышцы и компенсаторные возможности сердечно-сосудистой системы в целом. Так, у ряда пациентов отмечено развитие сердечной недостаточности с высоким сердечным выбросом при скорости кровотока по фистуле 0,8-1,0 л/мин .
Типичные проявления сердечной недостаточности с высоким сердечным выбросом, обусловленной наличием функционирующего ПСД, включают тахикардию, высокое пульсовое давление, гипердинамический прекордиум, напряжение яремных вен и высокий (2000 мл/мин) кровоток по фистуле . Прогрессирование сердечной недостаточности сопряжено с высоким риском развития сердечно-сосудистых осложнений, отрицательно влияющих на продолжительность жизни больных на ГД . Хирургическая тактика в данном случае включает попытку реконструкции ПСД с целью снижения объёмного кровотока по фистуле. При невозможности выполнения хирургической коррекции лигирование фистулы является наиболее радикальным решением проблемы, однако, требует формирования нового ПСД для проведения ГД.
1.4.8. Ишемическая мономелическая (мономерная) нейропатия Изменение гемодинамики в конечности после формирования ПСД может приводить к развитию ещё одного вида осложнений – ишемической мономелической нейропатии (ИМН). Впервые её описал Wilborn ещё в 1983 году, однако, до настоящего момента патофизиология данного явления остается неясной . Предположительно, развитие ИМН является следствием и/или разновидностью синдрома артериального обкрадывания в конечности, преимущественно из артерий, снабжающих крупные нервные волокна. Несмотря на то, что нервная ткань весьма чувствительна к ишемии, в норме, периферические нервы сопровождаются целой сетью артериальных сосудов для поддержания достаточной перфузии. Однако такие заболевания как СД, ведущие к дегенерации vasa nervorum, снижают компенсаторные возможности системы. Другим фактором риска является использование a.brachialis в качестве артерии-донора, что снижает резервы коллатерального артериального кровотока. Клинически ИМН проявляется сразу после формирования ПСД и характеризуется утратой сенсорно-моторной функции конечности при отсутствии клинических признаков ишемии. Лечебная тактика в данном случае состоит в незамедлительном лигировании сосудистого доступа. ИМН является достаточно редким осложнением ПСД, однако, требует ранней диагностики и своевременной коррекции. При отсутствии лечения ИМН приводит к атрофическим изменениям в тканях, перманентному болевому синдрому и деформации конечности с утратой её функции.
1.5. Пути профилактики осложнений ПСД
Важно отметить, что сохранение сосудистого ресурса пациента должно быть одним из важнейших приоритетов среди пациентов с ХБП задолго до начала лечения методом программного ГД. Согласно руководству KDOQI, у пациента с ХБП 4 и 5 стадий следует отказаться от пункций поверхностных вен конечностей и установки катетеров, в том числе в подключичные вены .
Немаловажную роль в дооперационном периоде играет тщательный сбор анамнеза, направленный на выявление событий, способных повлиять на тактику лечения пациента или на объём предоперационного обследования (установки ЦВК и ЭКС, иные манипуляции или операции на сосудах конечностей, наличие сопутствующих заболеваний и др.) .
При выборе типа планируемого ПСД предпочтение отдается нативной АВФ, что связано с более длительными сроками функционирования и минимальным риском развития осложнений в сравнении с другими типами ПСД . Важнейшим условием для формирования АВФ является наличие пригодных поверхностных вен. В противном случае необходимо рассмотреть альтернативные типы ПСД.
Согласно руководству KDOQI, наиболее предпочтительным методом исследования сосудистого русла конечностей на дооперационном этапе является ультразвуковое ангиосканирование (УЗАС) .
Согласно ряду исследований, использование УЗАС ведёт к увеличению доли АВФ среди всех формируемых ПСД . В работе Silva и соавт. показано, что использование поверхностных вен диаметром более 2,5 мм по данным УЗАС увеличило долю формируемых АВФ до 63% в сравнении с 14% до использования УЗАС . Mendes и соавт. также сообщают об успешном формировании АВФ при использовании вен не менее 2,5 мм в диаметре .
С помощью УЗАС возможно косвенно оценить центральные вены на наличие окклюзии . В сравнении с инвазивной флебографией при обнаружении окклюзии центральных вен УЗАС демонстрирует специфичность 97% и чувствительность 81% . В качестве альтернативны могут быть использованы и другие методы визуализации, основными из которых являются венография и МРА .
НАГРУЗКИ 14.03.06 – фармакология, клиническая фармакология ДИССЕРТАЦИЯ на соискание ученой степени...»
«Белякова Вера Владимировна СОВЕРШЕНСТВОВАНИЕ ЛАБОРАТОРНОГО ТЕСТИРОВАНИЯ ДЛЯ ОБЕСПЕЧЕНИЯ ВИРУСНОЙ БЕЗОПАСНОСТИ АЛЛОГЕННЫХ ГЕМОКОМПОНЕНТОВ 14.01.21 – гематология и переливание крови ДИССЕРТАЦИЯ на соискание ученой степени кандидата биологических наук Научный руководитель Рагимов Алигейдар Алекперович доктор медицинских наук, профессор МОСКВА 2014...»
«Куликова Светлана Александровна ОРГАНИЗАЦИЯ СТОМАТОЛОГИЧЕСКОЙ ОРТОПЕДИЧЕСКОЙ ПОМОЩИ ВОЕННОСЛУЖАЩИМ, ОФИЦЕРАМ ЗАПАСА И ЧЛЕНАМ ИХ СЕМЕЙ В СОВРЕМЕННЫХ УСЛОВИЯХ (на примере КДП ФКУ «МУНЦ им. П.В. Мандрыка») 14.02.03 Общественное здоровье и здравоохранение Диссертация на соискание ученой степени кандидата медицинских наук Научный руководитель: доктор медицинских наук, Лившиц Сергей Анатольевич Москва -2015 ОГЛАВЛЕНИЕ ВВЕДЕНИЕ..4...»
«КАН ВАДИМ ВАДИМОВИЧ ОПТИМИЗАЦИЯ ИННОВАЦИОННОЙ ДЕЯТЕЛЬНОСТИ В НАУЧНОЙ МЕДИЦИНСКОЙ ОРГАНИЗАЦИИ 14.02.03 – общественное здоровье и здравоохранение Диссертация на соискание ученой степени кандидата медицинских наук Научный руководитель: доктор медицинских наук, профессор Бедорева Ирина Юрьевна Новосибирск ОГЛАВЛЕНИЕ СОКРАЩЕНИЯ..3 ВВЕДЕНИЕ..4 Глава 1. ИННОВАЦИОННАЯ...»
«ДАВИДЕНКО ОКСАНА ПЕТРОВНА КОМПЛЕКСНАЯ ХАРАКТЕРИСТИКА СИНДРОМА ДИАБЕТИЧЕСКОЙ СТОПЫ У ПРИШЛОГО НАСЕЛЕНИЯ СЕВЕРНЫХ ТЕРРИТОРИЙ 14.01.02 – эндокринология Диссертация на соискание ученой степени кандидата медицинских наук Научный руководитель: д.м.н., профессор Я.В. Гирш Сургут – 2015 ОГЛАВЛЕНИЕ СПИСОК СОКРАЩЕНИЙ..4...»
«ИЗ ФОНДОВ РОССИЙСКОЙ ГОСУДАРСТВЕННОЙ БИБЛИОТЕКИ Златкин, Михаил Григорьевич Развитие коммерческих отношений в сфере медицинских услуг на основе формирования корпоративных структур управления Москва Российская государственная библиотека diss.rsl.ru Златкин, Михаил Григорьевич Развитие коммерческих отношений в сфере медицинских услуг на основе формирования корпоративных структур управления: [Электронный ресурс] : Дис. . канд. экон. наук: 08.00.05. М.: РГБ, 2006 (Из фондов Российской...»
«КРИВКО АЛЕНА АНАТОЛЬЕВНА ИНСУЛИНОМА: ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ И РАЗРАБОТКА СОВРЕМЕННОГО ПРОТОКОЛА ТОПИЧЕСКОЙ ДИАГНОСТИКИ И РЕАБИЛИТАЦИИ 14.01.02. – эндокринология ДИССЕРТАЦИЯ на соискание ученой степени кандидата медицинских наук Научный руководитель: Академик РАН И. И. Дедов Москва 2015 г. ОГЛАВЛЕНИЕ Список сокращений..4 Введение...6 Актуальность работы..6 Цель и задачи...» соискание учёной степени кандидата медицинских наук Научный руководитель: доктор медицинских наук, профессор А. П. Торгунаков Кемерово 201...»«РЕМЕЗОВ Андрей Владимирович ЭТАПНОЕ ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ГНОЙНО-НЕКРОТИЧЕСКИХ ОСЛОЖНЕНИЙ СИНДРОМА ДИАБЕТИЧЕСКОЙ СТОПЫ. 14.01.17 – хирургия Диссертация на соискание ученой степени кандидата медицинских наук Научный руководитель: доцент, кандидат медицинских наук, доцент В.В. ПЕТРОВА Санкт-Петербург Оглавление ВВЕДЕНИЕ ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ 1.1 ИСТОРИЯ ИЗУЧЕНИЯ САХАРНОГО ДИАБЕТА И ЕГО ХИРУРГИЧЕСКИХ ОСЛОЖНЕНИЙ. 9 1.2....»
«НЕДБАЙКИН АНДРЕЙ МИХАЙЛОВИЧ Отдаленные результаты радиочастотной абляции и факторы, способствующие повышению ее эффективности, у больных с фибрилляцией предсердий 14.00.05 – кардиология Диссертация на соискание ученой степени кандидата медицинских наук Научный руководитель: доктор медицинских наук Линчак...»
«Сивова Евгения Николаевна Комбинированное лечение пролиферативных процессов эндометрия у женщин репродуктивного возраста 14.01.01 – акушерство и гинекология Диссертация на соискание ученой степени кандидата медицинских наук Научный...»
«ХУДЯКОВА Наталья Валерьевна СРАВНИТЕЛЬНАЯ ОЦЕНКА ВЛИЯНИЯ КОМПОНЕНТОВ МЕТАБОЛИЧЕСКОГО СИНДРОМА НА СЕРДЕЧНО-СОСУДИСТУЮ СИСТЕМУ У ЖЕНЩИН В ПЕРИМЕНОПАУЗЕ 14.01.04 – внутренние болезни ДИССЕРТАЦИЯ на соискание ученой степени кандидата медицинских наук Научный руководитель: доктор медицинских наук, профессор А. Н. Шишкин Санкт-Петербург ОГЛАВЛЕНИЕ СПИСОК СОКРАЩЕНИЙ ВВЕДЕНИЕ Глава 1. ОБЗОР ЛИТЕРАТУРЫ 1.1. Определение и...»
«Сафронова Мария Александровна ОПТИМИЗАЦИЯ АЛГОРИТМА ОБСЛЕДОВАНИЯ БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ НА ДОГОСПИТАЛЬНОМ ЭТАПЕ 14.01.12 – онкология 14.01.13 – лучевая диагностика, лучевая терапия Диссертация на соискание ученой степени кандидата медицинских наук Научный руководитель – доктор медицинских наук профессор В.И. Соловьев доктор медицинских наук профессор А. В. Борсуков Санкт-Петербург ОГЛАВЛЕНИЕ ВВЕДЕНИЕ..5 ГЛАВА 1.ОБЗОР...»
«МАСЛОВА Майя Анатольевна ПОДГОТОВКА ПАЦИЕНТОК С БЕСПЛОДИЕМ К ПРОГРАММЕ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ С УЧЕТОМ МОЛЕКУЛЯРНО–ГЕНЕТИЧЕСКИХ МАРКЕРОВ В ЭНДОМЕТРИИ 14.01.01 – Акушерство и гинекология Диссертация на соискание ученой степени кандидата медицинских наук Научные руководители: доктор...»
«КОКШУНОВА ЛЮДМИЛА ЕСИНОВНА Экология и адаптивные возможности сайгака (Saiga tatarica tatarica L., 1766) в условиях экстремального антропогенного пресса 06.02.05 ветеринарная санитария, экология, зоогигиена и ветеринарно-санитарная экспертиза ДИССЕРТАЦИЯ на соискание ученой степени доктора биологических наук Научный консультант: доктор биологических наук, профессор...»
«Клименко Татьяна Михайловна СОСТОЯНИЕ ГЕМОДИНАМИКИ У ПОДРОСТКОВ С АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ И ПОВЫШЕННЫМ КАРДИОВАСКУЛЯРНЫМ РИСКОМ 14.01.08 ПЕДИАТРИЯ Диссертация на соискание ученой степени кандидата медицинских наук Научный руководитель: доктор медицинских наук, профессор А.А. ЯЙЛЕНКО...»
2016 www.сайт - «Бесплатная электронная библиотека - Авторефераты, диссертации, конференции»
Материалы этого сайта размещены для ознакомления, все права принадлежат их авторам.
Если Вы не согласны с тем, что Ваш материал размещён на этом сайте, пожалуйста, напишите нам , мы в течении 1-2 рабочих дней удалим его.
Успешное, долголетнее лечение программным гемодиализом (ПГД) больных с терминальной стадией хронической почечной недостаточности (тХПН) в большей степени зависит от наличия адекватного сосудистого доступа.
Соответствующий доступ к сосудам является центральной проблемой длительного лечения больных с тХПН, поскольку он обеспечивает соединение больного с аппаратом «искусственная почка». Кровоток через диализатор аппарата должен быть адекватным, а для обеспечения эффективного диализа доступ «к крови» должен создавать техническую возможность проводить диализ трижды в неделю, фактически всю оставшуюся жизнь пациента или до приживления в его организме почечного трансплантата.
В настоящеее время существуют следующие методы сосудистого доступа.
Временные сосудистые доступы:
Артерио-венозные шунты (АВШ);
Катетеризация центральных вен (двухпросветные диализные катетеры, манжеточные силиконовые внутривенные катетеры (Tesio ª , Permcath ª , Ash Split Cath ª), катетеры Cannon ª II Plus из полиуретана и др.).
Постоянные сосудистые доступы (ПСД):
Нативная артерио-венозная фистула (АВФ);
АВФ с использованием аутовен;
АВФ с использованием алловен;
АВФ с использованием синтетического сосудистого протеза.
Для имплантации артерио-венозного шунта используют a.radialis и v.cephalica в нижней или средней трети предплечья. В послеоперационном периоде, с целью профилактики тромбоза назначают гепарин по 2500ед 4 раза в сутки.
Сосудистые осложнения (тромбозы, инфекции и кровотечения) у больных, находящихся на лечении ПГД с наружными АВШ, встречаются очень часто.
Все эти осложнения значительно ухудшают состояние больного, удлиняют сроки лечения, увеличивают его стоимость, снижают результаты диализной терапии и пересадки почки.
В последние годы для проведения острого гемодиализа при ОПП и при невозможности или нецелесообразности формирования ПСД у определенной категории пациентов с тХПН применение двухпросветных диализных катетеров, манжеточных силиконовых внутривенных катетеров (рис. 19.1.5) является оправданным, а во многих случаях и единственно приемлемым. Однако только около 30-40% манжеточных катетеров остаются функционально пригодными через 1 год. Кандидатами для постановки манжеточных внутривенных катетеров могут рассматриваться только пациенты, у которых невозможно сформировать ПСД или проводить заместительную терапию методом перитонеального диализа.
Преимуществом применения этих катетеров является тот факт, что сохраняются артерии и вены конечностей для дальнейшего формирования АВФ. Также следует учесть малоинвазивность метода для проведения экстракорпоральной детоксикации, устранение артерио-венозного сброса, который усугубляет явления сердечной недостаточности и простоту их имплантации по методу Seldinger S.I. (1953). Применение этих катетеров предупреждает развитие большого количества гнойно-септических осложнений, что создает возможность формирования АВФ в условиях отсутствия гнойных ран и развившегося тромбоза сосудов конечностей.
Катетеризацию центральных вен производят при необходимости проведения экстренного гемодиализа, например, при быстром нарастании симптомов уремии, развитии гипергидратации, гиперкалиемии и отсутствии АВФ.
Рисунок 19.1.5. Стандартное положение туннельного катетера в правом предсердии
Все таки, большое количество различных осложнений (тромбозы, нагноения и кровотечения) вплоть до смертельных исходов, необходимость длительного (многолетнего) лечения больных гемодиализом требует более совершенных форм создания сосудистых доступов. Одним из них является способ формирования различного вида АВФ.
Основными условиями для формирования длительно функционирующих АВФ являются: правильный выбор места и своевременность проведения операции, высокая микрохирургическая техника и определение периода времени между формированием АВФ и ее использованием (рисунок 19.1.6).

Рисунок 19.1.6. Возможные хирургические участки для формирования АВФ
При формировании нативных АВФ используют недоминантную руку и те же сосуды в нижней или средней трети предплечья. Под местной анестезией или внутривенным наркозом через один косой разрез выделяют a.radialis и v.cephalica на протяжении 3-4см, коллатерали, отходящие от основного ствола, легируют. Дистальные концы сосудов перевязывают и пересекают, в проксимальный конец вводят гепаринизированный раствор с целью профилактики тромбоза во время оперативного вмешательства, и с помощью специальных инструментов, с использованием нерассасывающегося атравматического шовного материала №6,0; 7,0; 8,0, накладывают анастомоз по типу «бок в бок», «конец в бок» или «конец в конец» (рисунок 19.1.7). В послеоперационном периоде больные получают гепарин в течение 7-10 дней и через 1-2мес артериализованную вену пунктируют специальными диализными иглами для соединения с магистралями аппарата «искусственная почка».

Рисунок 19.1.7. Варианты формирования артерио-венозных анастомозов и АВФ на сосудах предплечья (А.М.Шепетов, 1998).
Таким образом, количество осложнений при использовании нативных АВФ по сравнению с использованием АВШ значительно меньше, 20% и 47% соответственно. С целью уменьшения количества осложнений, улучшения условий проведения лечения гемодиализом, больным с тХПН рекомендуется раннее формирование АВФ на типичном месте.
Методы антикоагуляции.
Во время гемодиализа кровь выходит в экстракорпоральный контур, состоящий из игл, кровопроводящих магистралей с воздушной ловушкой и диализатора, что приводит к активации тромбоцитов и плазменных факторов свертывания. Поэтому антикоагуляция является обязательным компонентом диализа. Методы антикоагуляции включают системную гепаринизацию, инфузию простациклина или регионарную цитратную антикоагуляцию .
Основной метод антикоагуляции – системная гепаринизация. Механизм антикоагулянтного действия гепарина заключается в торможении активности тромбина, который катализирует превращение фибриногена в фибрин в системе гемостаза. Гепарин тормозит тромбообразование, способствуя инактивации тромбина его физиологическим ингибитором антитомбином III. В таблице 19.1.3 приведены рекомендации по использованию гепарина в зависимости от наличия/отсутствия риска кровотечения.
Существует 2 метода введения гепарина:
1) постоянная непрерывная инфузия с минимальным болюсом в начале диализа,
2) периодический болюс гепарина.
При наличии гепариновой помпы в аппарате «ИП» более предпочтительным является постоянная инфузия, так как это позволяет добиться адекватной управляемой антикоагуляции с меньшим риском кровотечения и более быстрой инактивацией гепарина при окончании диализа. Рекомендуемые дозы введения гепарина представлены в таблице 19.1.3.
(John T. Daugirdas, Handbook of dialysis, 2001)
Контроль за адекватностью антикоагуляции осуществляется как клиническими методами: визуальный осмотр экстракорпорального контура, разность давлений на входе и выходе диализатора и кровопроводящих магистралей, а также лабораторной оценкой свертываемости крови (табл. 19.1.4).
Таблица 19.1.4. Предраспологающие факторы и признаки тромбоза крови в экстракорпоральном контуре
| Факторы, способствующие свертыванию крови в экстракорпоральном контуре |
| - Низкая скорость кровотока - Высокий гематокрит - Высокий уровень ультрафильтрации - Рециркуляция в доступе - Инфузия крови или компонентов крови во время диализа - Инфузия жировых растворов в процессе диализа - Наличие воздушных ловушек (экспозиция с воздухом, пенообразование, турбулентное движение крови) |
| Признаки сгущения крови в экстракорпоральном контуре |
| - Чрезмерно темная кровь - Темные участки или полосы в диализаторе - Образование пены с последующим формированием тромба в венозной ловушке - Быстрое заполнение кровью линий датчиков давления - Маятникообразное движение крови в сегменте между диализатором и венозной ловушкой - Наличие сгустков в артериальном конце диализатора |
Антидотом гепарина является протамин сульфат, доза введения которого зависит от многих факторов (дозы и времени гепарина, показателей АВС и АЧТВ и т.д.).
К побочным эффектам гепарина относятся: повышенная кровоточивость, зуд, остеопороз, дислипидемия, гепарин индуцированная тромбоцитопения. Альтернативой гепарина при развитии таких осложнений может служить низкомолекулярный гепарин (НМГ), к которому относятся надропарин кальций, эноксипарин.
Процедура гемодиализа. Контроль адекватности процедуры .
При проведении процедуры гемодиализа следует учитывать следующие параметры:
Скорость кровотока. Чем быстрее кровь поступает в экстракорпоральный контур, тем быстрее очищается организм и в диализатор поступает больший объем крови. Средняя рекомендуемая скорость установки насоса крови 5мл/кг/мин (напр., вес-70кг, кровоток-350мл/мин). Таким образом, весь ОЦК пациента проходит через диализатор порядка 20раз за 1 процедуру (4часа). Такую скорость можно добиться лишь при наличии адекватного сосудистого доступа – артерио-венозной фистулы.
Длительность. Чем дольше длится диализ, тем лучше очищается организм от уремических токсинов. Почки здорового человека работают 24часа в сутки, ежесекундно фильтруя конечные продукты азотистого обмена. Минимально рекомендуемая длительность процедуры гемодиализа при адекватной скорости кровотока (не менее 300мл/мин) – 4часа. Недавние исследования показывают, что увеличение длительности диализа на 30мин уменьшает смертность пациентов на 15%. Наилучший показатель выживаемости пациентов зафиксирован в округе Тассин (Франция), где проводят ночной 8-часовой гемодиализ. У 80% пациентов с этого региона не было необходимости в применении антигипертензивных и фосфор-связывающих препаратов. Кроме того, при такой длительности диализа, как ни странно, зафиксировано наименьшее количество осложнений, связанных с самой процедурой диализа (синдиализная гипо-, гипертензия, кровотечение).
Частота проведения. Опять же, если проводить аналогию с почками, клиренс происходит ежедневно. Следовательно, чем чаще проводится гемодиализ, тем лучше очищение организма. При ежедневном проведении гемодиализа (6 раз в неделю) длительность процедуры можно уменьшить до 2,5-3часов. Наименьшая частота кардиоваскулярных заболеваний зафиксирована у пациентов на ежедневном ночном 8-часовом гемодиализе. Минимально рекомендуемая частота проведения диализа – 3раза в неделю по 4 часа при адекватной скорости кровотока.
Ультрафильтрация. При развитии 5стадии ХБП, в особенности, у пацентов на гемодиализе, постепенно развивается олигоанурия. Сам диализ подразумевает собой удаление жидкости, в норме выводимой почками. Принципиальное различие гемодиализа от перитонеального диализа в зеркальных исходах в зависимости от объема ультрафильтрации. При перитонеальном диализе малый объем ультрафильтрации (менее 750мл/сут) сопряжен с высокой смертностью, тогда как на гемодиализе, наоборот, высокий объем ультрафильтрации (более 4,8% от массы тела за процедуру, например, вес 60кг, УФ-3л и более) увеличивает смертность. Важно постоянно проводить беседу с пациентами о необходимости в ограничении приема соли и соленых продуктов (копчености, консервы, полуфабрикаты), а также соблюдения водного режима.
Диализ должен проводиться как минимум 3 раза в неделю, с общей продолжительностью сеансов не менее 12 часов в неделю, даже в том случае, когда имеется остаточная функция почек.
Увеличение продолжительности и/или частоты сеансов может потребоваться для пациентов с гемодинамической или сердечно-сосудистой нестабильностью.
Продолжительность и/или частоту сеансов диализа следует увеличивать, если у пациента сохраняется АГ, несмотря на максимально возможное выведение жидкости.
Увеличение продолжительности и/или частоты сеансов может потребоваться для пациентов с неконтролируемым нарушением фосфорного обмена.
Увеличение продолжительности и/или частоты сеансов может потребоваться для пациентов с нарушением питания.
Контроль адекватности гемодиализа.
Маркером для контроля адекватности гемодиализа служит мочевина. Мочевина вырабатывается печенью из азота аминокислот через аммиак, что является основным путем выведения азотистых шлаков из организма. Генерация мочевины происходит пропорционально разрушению белка или темпу появления белка. Кроме того считается, что мочевина распределена в общей воде тела, как во внеклеточной, так и внутриклеточной жидкости. Поэтому степень удаления мочевины позволяет оценить адекватность диализа. Креатинин в данном случае не может служить надежным маркером, так как не распределен равномерно по жидкостным пространствам организма.
Формулы расчета адекватности диализа.
Наиболее простой и вместе с тем эффективной формулой оценки диализа служит вычисление доли снижения мочевины (ДСМ).
ДСМ=(мочевина до ГД – мочевина после ГД)/мочевина до ГД*100
Диализ считается адекватным, если ДСМ равен или выше 65%.
Более точно оценить качество диализа можно посредством расчета Kt/V. Эта формула представляет собой отношение, отражающее клиренс мочевины, где К – клиренс диализатора по мочевине крови, в литре/час; t – проложительность процедуры, час; V – объем распределения мочевины, литр. Есть несколько способов, которые позволяют вычислить значение Kt/V. Математический способ использует формулу Даугирдаса:
Kt/V= - ln(R - 0.008 × t) + (4 - 3.5 × R) × UF/W
ln - натуральный логарифм
R - мочевина после ГД/ мочевина до ГД
t - продолжительность гемодиализа в часах
UF - объем ультрафильтрации в литрах
W - вес пациента после гемодиализа в кг
Проведенные исследования показали более высокую смертность пациентов при Kt/V менее 1,2. Большинство диализных центров стараются достигать показателей Kt/V в пределах 1,4-1,6. В нашей стране минимально допустимым считается уровень 1,2. Неудобство математического расчета связано необходимостью забора крови для проведения лабораторного анализа. Немаловажен и человеческий фактор: требуется строго соблюдать технику, место и время забора крови по окончании гемодиализа для правильного вычисления Kt/V, что бывает не всегда возможно при большой загруженности диализного центра.
Все современные аппараты «ИП» измеряют Kt/V в режиме реального времени (онлайн), позволяя при необходимости проводить коррекцию при проведении гемодиализа. Например при низком фактическом Kt/V аппарат «ИП» будет указывать на необходимое дополнительное время диализа для достижения заданного уровня. Это, в принципе, невозможно при математическом вычислении. При сравнении обоих методов, разница составила менее 5%, что делает онлайн измерение Kt/V самым популярным методом оценки адекватности гемодиализа у нефрологов.
Хроническая почечная недостаточность (ХПН) является неизбежным исходом ряда заболеваний почек. Количество больных с ХПН постоянно растет. В 2014 году 2 млн человек в мире имели последнюю (терминальную) стадию ХПН, т. е. находились на гемодиализе, перитонеальном диализе или нуждались в донорской почке.
За последние 20 лет число подобных пациентов увеличилось в 4 раза. Количество больных с начальной стадией ХПН превышает число больных с последней стадией ХПН более чем в 50 раз. В настоящее время количество больных увеличивается ежегодно на 10-12 %.
Адекватная гемодиализная терапия требует наличия постоянного сосудистого доступа (ПСД) и регулярного контроля за его состоянием. Идеальным сосудистым доступом признается такой, который обеспечивает соответствие скорости кровотока назначенной дозе диализа, функционирует долго (многие годы) и не имеет осложнений. В настоящее время ни один из известных вариантов ПСД не является идеальным, тем не менее в большей степени предъявляемым требованиям удовлетворяет нативная артерио-венозная фистула (АВФ).
Осложнения, связанные с ПСД, являются основной причиной заболеваемости, госпитализации и увеличения стоимости лечения больных на постоянном гемодиализе (ПГД). Процедуры, связанные с сосудистым доступом, требуют госпитализации от 14 до 45 % гемодиализных пациентов, расходы составляют 10 % бюджета, выделенного на лечение больных с ХПН: к примеру, подобные расходы в США оцениваются более чем в 1 миллиард долларов ежегодно.
Улучшение качества ПГД и увеличение выживаемости пациентов приводят наряду с дефицитом почечных трансплантатов к удлинению сроков нахождения пациентов на ПГД. Вследствие этого возрастают требования к более продолжительному функционированию сосудистых доступов. С другой стороны, среди пациентов, нуждающихся в формировании первичного ПСД, растет доля пожилых, страдающих сахарным диабетом и сердечно-сосудистыми заболеваниями, что ведет к увеличению как интенсивности сосудистых вмешательств, так и технических трудностей при формировании ПСД.
Несмотря на то что в последние годы в технологии диализа достигнут значительный прогресс, определенные проблемы, связанные с обеспечением постоянного сосудистого доступа, остаются нерешенными. Многочисленные исследования посвящены вопросам планирования, приоритетности вида ПСД, вариантам тактики лечения при развитии осложнений.
В отношении периода создания ПСД существует единая точка зрения. Оптимальной признается ситуация, когда имеется возможность формирования ПСД как минимум за несколько месяцев до предполагаемого начала ПГД. Большинство авторов считают, что такой момент наступает при показателях креатинина плазмы крови 4-5 мг/дл и скорости клубочковой фильтрации 15-25 мл/мин.
Преимущества такого подхода очевидны: запас времени для «созревания» АВФ и заживления послеоперационной раны, достижение адекватного кровотока по АВФ, отсутствие необходимости во временном сосудистом доступе с сопутствующими ему осложнениями (инфицирование, стеноз магистральной вены, повреждение артерии). Тем не менее проблема остается актуальной в связи с тем, что доля пациентов, которым ПСД сформирован заблаговременно, остается недостаточной и составляет, по данным различных авторов, от 32 до 50%.
За четыре десятилетия своего существования гемодиализ стал вполне самостоятельной и полноценной дисциплиной, которая способствовала развитию целой отрасли медицинской промышленности. За этот период накоплен и проанализирован большой опыт длительного замещения утраченной функции почек у сотен тысяч пациентов.
На качественно новый уровень проблема гемодиализа вышла в начале XIX века, когда с развитием биохимии стали понятны многие процессы, которые впоследствии легли в основу заместительной почечной терапии. Физические основы гемодиализа заложил в 1854 году шотландский ученый Томас Грэхэм, опубликовав свой труд «Осмотическая сила», в котором впервые описал способ изготовления полупроницаемых мембран из специально обработанного пергамента для разделения коллоидных и кристаллоидных растворов.
Первый гемодиализ человеку (пациенту, страдающему уремией) был проведен в Германии врачом Георгом Хаасом в октябре 1924 года. В качестве антикоагулянта использовался очищенный гирудин. В 1927 году впервые при гемодиализе в качестве антикоагулянта был применён гепарин. Таким образом, Хаас был первым, кто свёл вместе все составляющие, необходимые для успешного гемодиализа.
Впервые успешное выведение человека из уремической комы с помощью гемодиализа осуществил 3 сентября 1945 года голландский медик Виллем Кольф. Таким образом, на практике была однозначно доказана клиническая эффективность метода. В 1946 году Виллем Кольф издал первое руководство по лечению больных уремией с помощью гемодиализа.
Началом эпохи хронического гемодиализа считается 1960 год, когда Белдингу Скрибнеру и Вейну Квинтону удалось решить проблему долгосрочного сосудистого доступа, который обеспечивался путем имплантации в лучевую артерию и подкожную вену двух тонкостенных тефлоновых трубок. Эта методика в подавляющем большинстве случаев требовала перевязки сосудов в конце процедуры и приводила к быстрому истощению сосудистого ресурса.
Катетеризация сосудов по методике S. I. Seldinger, впервые примененная S. Shaldon в 1961 году, была сопряжена с высоким риском инфекционных, геморрагических и тромбоэмболических осложнений. С усовершенствованием используемых материалов и внедрением так называемых перманентных катетеров длительность пребывания их in vivo значительно увеличилась, и последнее время их можно рассматривать в качестве постоянного сосудистого доступа.
У данной методики тем не менее имеется много недостатков, в связи с чем применение она находит у соматически тяжелых больных с исчерпанным сосудистым ресурсом, а также в качестве промежуточного доступа в период формирования постоянного. Приоритет в месте пункций на сегодняшний день выглядит следующим образом: яремная вена; бедренная вена; подключичная вена.
Внедрение длительного гемодиализа в широкую клиническую практику началось после предложения В. Н. Scribner (1960) применять для повторных процедур наружный артерио-венозный шунт в области предплечья. Предложенный шунт первоначально был выполнен из тефлона. Использование в последующем шунтов с дакроновыми и тефлоновыми манжетами позволяло избегать развития инфекций, повреждения интимы и, как следствие, ее гиперплазии. Однако высокий уровень осложнений и ограниченные сроки функционирования таких шунтов (для артериального сегмента максимально 1-2 года, для венозного — 10-12 месяцев) не позволяют использовать их в качестве постоянного сосудистого доступа.
Прорыв в области обеспечения постоянного сосудистого доступа был достигнут после разработки М. J. Brescia и J. Е. Cimino в 1996 году операции создания подкожной артерио-венозной фистулы. Было предложено формировать сосудистый анастомоз между a. radialis и v. cephalica в области нижней трети предплечья по типу «бок вены в бок артерии». В настоящее время приоритетным является метод наложения анастомоза по принципу конец вены в бок артерии, реже конец вены в конец артерии.
У 20 % больных на определенном этапе гемодиализа приходится прибегать к имплантации сосудистых протезов в качестве альтернативы артерио-венозной фистуле, так как возможности использования собственных сосудов оказываются полностью исчерпаны. Основными показаниями для применения сосудистых протезов являются особенности анатомического строения периферических сосудов (недостаточный диаметр, рассыпной тип строения), их паталогические изменения (тромбозы, стенозы, флебиты, аневризмы), а также предшествующие оперативные вмешательства.
Многочисленные разновидности сосудистых протезов составляют три основные группы: биологические (аутовена, алловена, аллоартерия, ксенотрансплантаты), полубиологические(протез из вены пуповины человека), синтетические (дакрон, политетрафторэтилен).
Высокая частота тромбозов и окклюзии в отдаленном послеоперационном периоде вследствие быстро прогрессирующей биодеградации венозного трансплантата, травматичность и длительность оперативного вмешательства препятствовали широкому использованию аутотрансплантатов.
Наилучшие результаты были достигнуты при использовании для изготовления сосудистых протезов синтетических материалов (дакрон, лавсан, велюр, мандрил, политетрафторэтилен, полиуретан). Клинические исследования показали абсолютные преимущества синтетических сосудистых протезов (ССП) из политетрафторэтилена (ПТФЭ), выпускаемых под различными коммерческими названиями (Goretex, DIASTAT, Impra, Vectra и др.).
ССП из ПТФЭ инертен, механически и химически стабилен, устойчив к биологическому разрушению, высоко тромборезистентен, эластичен, не деформируется при сгибании, прост и удобен в применении. Микропористая структура ПТФЭ позволяет прорастать внутрь протеза соединительной ткани и сосудам, способствует формированию неоинтимы и соединительнотканной капсулы, придавая ему свойства полубиологического заменителя.
Первоначальные попытки тотального применения ССП показали, что данный метод не имеет существенных преимуществ перед нативной АВФ, а по ряду показателей значительно ей уступает.
В последние годы отмечена тенденция как к ограничению показаний для применения ССП в качестве первичного сосудистого доступа, так и к увеличению доли операций с применением сосудистых протезов при выполнении повторных доступов и реконструктивных вмешательств.
Это объясняется, с одной стороны, меньшей длительностью функционирования ССП и большим количеством необходимых корригирующих процедур (тромбэктомия и ангиопластика) в ближайшем и отдаленном послеоперационном периодах по сравнению с нативными АВФ. Кроме этого, ССП являются серьезным фактором риска в отношении развития инфекционных осложнений.
С другой стороны, улучшение качества гемодиализа ведет к увеличению как продолжительности жизни, так и доли пожилых пациентов и лиц с сопутствующими заболеваниями. Это требует увеличения длительности функционирования ПСД. В подобной ситуации сосудистые протезы являются незаменимым элементом при выполнении множественных повторных хирургических вмешательств по поводу формирования новых и реконструкции имеющихся сосудистых доступов.
Применение манжеточных силиконовых внутривенных катетеров, получившее распространение в последние годы, является оправданным, а во многих случаях и единственно приемлемым для проведения хронического гемодиализа при невозможности или нецелесообразности формирования ПСД у определенной категории пациентов (с исчерпанным ресурсом нативных сосудов, невозможностью проведения гемодиализа, маленькие дети, пациенты с сахарным диабетом и др.).
Однако лишь около 30 % манжеточных катетеров остаются функционально пригодными через 1 год, даже с учетом выполнения тромбэктомий, а частота развития инфекционных осложнений и смертность существенно превышают таковую при формировании АВФ и имплантации ССП. Все это не позволяет в полной мере отнести данный вид сосудистого доступа к категории постоянного.
Кандидатами для постановки манжеточных внутривенных катетеров могут рассматриваться только пациенты, у которых невозможно сформировать ПСД или проводить заместительную терапию методом перитонеального диализа.
В последние годы для клинического применения предложен принципиально новый вариант сосудистого доступа, сочетающий преимущества внутривенного катетера (достаточный кровоток в магистральной вене, минимальное влияние на сердечный выброс, простота установки) и подкожных пункций (профилактика инфекционных осложнений) – устройства «Dialock hemodialysis system» («Biolink Corp.») и «LifeSite hemodialysis access system» («Vasca Inc.»).
Система состоит из порта для множественных пункций, имплантируемого подкожно в подключичной области и соединенного с двумя силиконовыми катетерами, установленными через яремную вену в правое предсердие или верхнюю полую вену. Предполагается, что подобные системы должны стать альтернативой внутривенным катетерам (в том числе манжеточным) и обеспечить безопасный временный сосудистый доступ на период формирования и «созревания» постоянного. С учетом небольшого на сегодняшний день мирового опыта применения данного метода не представляется возможным оценить в полной мере его эффективность.
Стратегическим направлением улучшения сохранности функции ПСД большинством гемодиализных центров предлагается не формирование нового сосудистого доступа, а обеспечение максимально продолжительной функции уже имеющегося путем своевременной диагностики осложнений, чрескожной интервенции и ангиопластики, стентирования, хирургической реконструкции.
После обобщения всех доступных данных рабочая группа по проблемам сосудистого доступа пришла к выводу, что качество жизни гемодиализных больных и общие результаты лечения могут быть заметно повышены, если возрастет количество сформированных нативных АВФ, и дисфункция доступа будет распознаваться до развития его тромбоза.
С этой целью значительное внимание уделено характеристикам кровотока ПСД методами ангиографии, ультразвукового исследования, термодилюции, определения венозного сопротивления и рециркуляции. Доказано, что проспективный контроль и коррекция гемодинамически значимого стеноза способствуют улучшению функции сосудистого доступа и снижению числа осложнений, в первую очередь — тромбозов.
Несмотря на наличие широкого спектра методов формирования постоянного сосудистого доступа, которыми владеют хирурги, нерешенных проблем остается много. Основной, пожалуй, является стенозирование и, как следствие, тромбоз анастомоза за счет формирования неоинтимы. Постоянные пункции диализных вен и сосудистых протезов толстыми иглами вызывают защитные процессы воспаления, локального пристеночного тромбообразования. В случае окончания процедуры гемодиализа этот процесс имеет благоприятные последствия, способствуя закрытию пункционных отверстий и препятствуя кровотечению. В общем же он приводит к дисфункции эндотелия и гиперплазии неоинтимы.
Эндотелий участвует как в инициации, так и в завершении процесса воспаления за счет белковых рецепторов (межклеточная молекула адгезии-1 — ICAM-1, сосудистая молекула адгезии-1 — VCAM-1, эндотелиальная лейкоцитарная молекула адгезии-1 — ELAM-1) и цитокинов, выделяемых в просвет сосудов (модифицированные липопротеины, воспалительные цитокины, вазоактивные пептиды, нейропептиды Р- и Е-селектины). Активаторы молекул адгезии лейкоцитов, такие как Е-селектин, Р-селектин, ICAM-1 и VCAM-1 позволяют лейкоцитам прикрепляться к эндотелию и затем перемещаться в ткани, увеличивая местный воспалительный ответ. Воспаление является одним из нескольких факторов, которые могут внести изменения в работу эндотелиальных клеток, вызвать повреждение эндотелиального слоя.
К настоящему времени накоплены данные о многогранности влияния эндотелия на возникновение и развитие различных патологических состояний. Это обусловлено не только участием эндотелиоцитов в регуляции воспаления, но и непосредственным их воздействием на сосудистый тонус, гемореологию и тромбообразование, защитой целостности сосудистой стенки, регуляцией атерогенеза и других процессов. Гемодиализ сам по себе вызывает оксидативный стресс и развитие эндотелиальной дисфункции (оксид азота, эндотелин 1, фактор Виллебранда и др.). Маркеры эндотелиальной дисфункции на сегодняшний день достаточно хорошо изучены.
Установлено, что гемодиализ вызывает повышение концентрации моноцитарного хемоаттрактантного белка 1, фактора роста гепатоцитов и пентаксина-3, зафиксировано снижение уровня асимметричного диметиларгинина и нитрата/нитритов. Сыворотка, полученная после гемодиализа, стимулирует пролиферацию эндотелиальных клеток. Индуцированное гемодиализом внутрисосудистое воспаление изменяет функцию эндотелия, что может приводить к образованию неоинтимы, к непроходимости 60 % АВФ и сосудистых протезов в течение 2 лет.
Эндотелиальные клетки артерио-венозных фистул мышей с уремией или пациентов на гемодиализе способны экспрессировать мезенхимальные маркеры (FSP-1 и/или a-SMA), им также свойственны повышенная экспрессия и ядерная локализация внутриклеточного домена Notch. Кроме того, в эндотелиоцитах, полученных из АВФ мышей с уремией, отмечено снижение уровня VE-кадгерина и повышение экспрессии Notch-1 и -4, лигандов Notch, транскрипции фактора Notch, RBP-JK и таргетных генов Notch.
Эктопическая экспрессия лигандов Notch или экспозиция TGF-]31 в культуре эндотелиоцитов являлись триггерными механизмами экспрессии мезенхимальных маркеров и вызывали дисфункцию эндотелия. Оба механизма могут быть заблокированы ингибированием Notch или выключением (нокаутом) RBP-JK. ЭТИ результаты позволяют предположить, что повышение уровня TGF-pi как осложнение уремии активирует домен Notch в эндотелиальных клетках, что приводит к прогрессивному формированию неоинтимы и непроходимости артерио-венозных фистул. Подавление активации Notch может стать новой стратегией к улучшению проходимости АВФ у пациентов с уремией.
Приводятся интересные данные о содержании оксида азота у больных с хронической почечной недостаточностью, получающих лечение гемодиализом. Уровни оксида азота у пациентов с ХПН на гемодиализе были заметно повышены, что связано как с самой процедурой гемодиализа (стимуляцией цитокин- индуцированной NO-синтазы), так и со стимуляцией выработки оксида азота тромбоцитами на фоне уремии. Высокие концентрации оксида азота действуют как цитотоксичные молекулы, приводя к осложнениям диализа вследствие нитрозативного стресса.
Так как выработка оксида азота коррелирует с концентрациями креатинина и мочевины, высокое его содержание, возможно, означает недостаточную степень очищения крови. Следовательно, изменения функции почек, которые отражаются в колебаниях концентрации креатинина, будут сопровождаться изменениями и в уровне оксида азота, определение которого в периферической крови может быть полезным в оценке эффективности гемодиализа и использоваться для определения прогноза у пациентов с ХПН. Изучение механизмов развития дисфункции эндотелия и гиперплазии интимы может способствовать улучшению понимания процессов, приводящих к стенозу и тромбозу постоянного сосудистого доступа.
Таким образом, накоплены обширные знания в области хирургических и эндоваскулярных методов создания, коррекции и поддержания проходимости постоянного сосудистого доступа у диализных пациентов. Ведутся разработки по усовершенствованию материалов для создания сосудистых протезов, поиски нового, идеального сосудистого доступа.
В настоящее время таковым является нативная артериовенозная фистула. Поиск медикаментозных способов коррекции и профилактики возможных осложнений будет способствовать «продлению жизни» уже имеющегося на сегодняшний день идеального сосудистого доступа.
Р. Е. Калинин, И. А. Сучков, А. С. Пшенников, Н. Д. Мжаванадзе, А. А. Егоров